
|
| 目 次:各メニューをクリックすると該当項目にリンクします。
|

|
| |
|
| |
|
| |
|
| |
|

|
| (Ⅰ)ガイドラインサマリー
|

|
| |
1. 画像診断
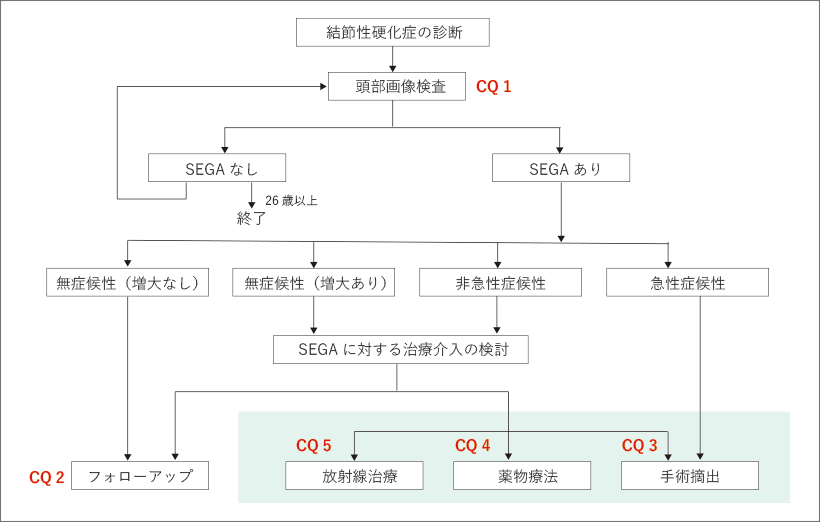
CQ1:結節性硬化症と診断された患者のフォローアップにおいて,頭部画像診断(MRIまたはCT)検査は無症候性SEGAの診断率を高めるために有用か?
推奨:結節性硬化症と診断された患者のフォローアップにおいて,無症候性SEGAの診断率を高めるために,頭部画像診断(MRIまたはCT)検査を行うことを提案する。(2C)
CQ2:非急性症候性または無症候性のSEGA患者に対して,定期的な頭部画像診断(MRIまたはCT)検査は有用か?
推奨:非急性症候性または無症候性のSEGA患者に対して,定期的な頭部画像診断(MRIまたはCT)検査を行うことを提案する。(推奨度2C) |
2. 手術
CQ3:非急性症候性または無症候性(増大あり)のSEGAに対する外科的摘出は,急性症候性となってから行われる場合と比較して有用か?
推奨:非急性症候性または無症候性(増大あり)のSEGAに対して,外科的摘出は,急性症候性となる前に外科的摘出を行うことを提案する。(推奨度2C)
|
3. 薬物療法
CQ4:非急性症候性または無症候性(増大あり)のSEGAに対して,外科的切除の対象とならない場合にmTOR阻害薬投与は有用か?
推奨:非急性症候性または無症候性(増大あり)のSEGAに対して,外科的切除の対象とならない場合にmTOR阻害薬の投与を提案する。(推奨度2C)
|
4. 放射線治療
CQ5:外科的切除の対象とならない非急性症候性または無症候性(増大あり)のSEGAに対して放射線治療は有用か?
推奨:非急性症候性または無症候性(増大あり)のSEGAに対して,外科的切除の対象とならない場合に 放射線治療を行わないことを提案する。(推奨度2D)
|
|
| 目次へ戻る!
|

|
| (Ⅱ)診療アルゴリズム
|

|
| |
|
| 目次へ戻る!
|

|
| (Ⅲ)用語・略語一覧
|

|
| |
重要用語の定義
|
| |
| 用語名 |
解説 |
| 上衣下結節(subependymal nodule:SEN) |
側脳室上衣下に認められる通常10mm以下の結節性病変。多発することが多い。石灰化を伴うこともある。腫瘍性増殖を示すことは原則としてないが,モンロー孔近傍に存在する場合はSEGAとの鑑別が必要となる。 |
| 腎血管筋脂肪腫(angiomyolipoma:AML) |
結節性硬化症の腎臓にしばしば両側性,多発性に発生する血管・平滑筋・脂肪から構成される腫瘍。10歳以降に発生することが多い。しばしば無症状のまま増大して巨大化する。突然,腫瘍内出血を生じることもある。腫瘍の大きさ,腫瘍血管の動脈瘤の状態などを考慮して治療を選択する。
|
| 体細胞変異 |
突然変異による TSC 遺伝子変異が体細胞系列の細胞集団に生じたもの。突然変異が生殖細胞系列との分化前に発生すると,体細胞変異は生殖細胞変異と共存するが,分化後であればどちらか一方の系列に限定したモザイクとなる。
|
| 大脳皮質結節(cortical tuber) |
結節性硬化症に合併する脳病変の一つ。大脳皮質に通常は複数の腫瘤状結節を形成する。結節の皮質下白質は MRI T2 強調画像で高信号域を示し,深部に向かう放射状神経細胞移動線を認めることがある。腫瘍性増大・神経活動も示すことはないが,周辺脳組織にてんかん原性を伴うことがある。
|
肺リンパ脈管平滑筋腫症
(lymphangioleiomyomatosis:LAM) |
平滑筋様の腫瘍細胞が肺で増殖して多発性のう胞を形成する。結節性硬化症の女性患者で20~40歳に発症することが多い。初期は無症状だが,進行すると自然気胸や動作時呼吸困難を生じるため,臨床的に重要な肺病変である。
|
| 不全型(モザイク等) |
結節性硬化症では個々の患者の表現度の差異が大きく臨床診断基準を満たさない不全型が存在する。その一つの機序としてモザイク変異が知られる。これは TSC 遺伝子変異が,受精後の突然変異で生じた場合であり,遺伝子変異を持つ細胞と持たない細胞が体内で混合する。この場合,結節性硬化症の臨床発現形態は遺伝子変異を持つ細胞にのみ発現するため不全型となる。
|
| mTOR |
細胞成長・増殖に不可欠なキナーゼタンパク。ラパマイシン(細胞の成長・増殖を抑制,mTOR 活性を抑制する薬物)の結合タンパク。異常な活性亢進は結節性硬化症や腫瘍性病変などの原因となる。
|
| mTOR シグナル伝達経路 |
インスリン・成長因子の刺激を受け,栄養・エネルギーのレベルを検知して,TSC1/TSC2複合体がそれらの情報を統合し,Rheb( Ras homolog enriched in brain )を介してmTOR複合体1( mTORC1 )活性を制御することにより細胞の成長・増殖,細胞骨格形成,栄養の取り込み,細胞死(アポトーシス)抑制などを調節する経路。
|
| TSC1 遺伝子 |
染色体9q34に位置しhamartinタンパクをエンコードする。結節性硬化症の発症にはTSC1/TSC2遺伝子変異が関与する。TSC2と結合して複合体(TSC complex)を形成し,mTORシグナル伝達経路においてmTOR活性を抑制する。
|
| TSC2 遺伝子 |
染色体16p13.3に位置しtuberinタンパクをエンコードする。TSC1と結合して複合体を形成し,mTOR 活性を抑制する。
|
|

|
| |
略語一覧
|
| |
| 略語名 |
正式名称 |
和語 |
| AML |
angiomyolipoma |
血管筋脂肪腫 |
| LAM |
lymphangioleiomyomatosis |
リンパ脈管平滑筋腫症 |
| mTOR |
mammalian(またはmechanistic)
target of rapamycin |
|
| QOL |
quality of life |
クオリティオブライフ,生活の質 |
| RCT |
randomized controlled trial |
ランダム化比較試験 |
| SEGA |
subependymal giant cell astrocytoma |
上衣下巨細胞性星細胞腫 |
| SEN |
subependymal nodule |
上衣下結節 |
| TSC |
tuberous sclerosis complex |
結節性硬化症 |
|
| 目次へ戻る!
|

|
| (Ⅳ)作成組織・作成方針
|

|
| 1. 作成組織
|

|
| |
1.1. 作成主体
|

|
| |
|
共通目次と共通項目参照
|

|
| |
1.2. 作成委員一覧
|

|
| |
上衣下巨細胞性星細胞腫(subependymal giant cell astrocytoma: SEGA)診療ガイドライン作成グループ
|
| |
|
| 代表 |
氏名 |
所属機関/専門分野 |
作成上の役割 |
| ○ |
市川 智継 |
香川県立中央病院 脳神経外科/脳神経外科 |
SEGAガイドライン作成ワーキンググループ委員長統括 |
| |
隈部 俊宏 |
北里大学医学部 脳神経外科/脳神経外科 |
SEGAガイドライン作成ワーキンググループ副委員長外科的治療に関する CQ |
| |
坂本 博昭 |
大阪市立総合医療センター
小児脳神経外科/脳神経外科 |
放射線治療に関する CQ |
| |
師田 信人 |
北里大学医学部
脳神経外科/脳神経外科 |
診断に関する CQ |
| |
安藤 雄一 |
名古屋大学医学部附属病院
化学療法部/腫瘍内科 |
ガイドライン作成方法の監修 |
| |
水口 雅 |
心身障害児総合医療療育センター
むらさき愛育園/小児科 |
薬物療法に関する CQ |
| |
久保田雅也 |
社会福祉法人日本心身障害児協会
島田療育センター 神経内科/神経内科 |
薬物療法に関する CQ |
| |
杉山 一彦 |
広島大学病院 がん化学療法科/脳神経外科 |
他のガイドラインとの整合性/校正 |
|

|
| |
1.3. システマティックレビューチーム(SR チーム)
|

|
| |
|
| 代表 |
氏名 |
所属機関/専門分野 |
作成上の役割 |
| ○ |
師田 信人 |
北里大学医学部
脳神経外科/脳神経外科 |
診断 |
| |
井原 哲 |
東京都立小児総合医療センター
脳神経外科/脳神経外科 |
診断 |
| ○ |
隈部 俊宏 |
北里大学医学部 脳神経外科/脳神経外科 |
外科的治療 |
| |
斉藤 竜太 |
東北大学 脳神経外科/脳神経外科 |
外科的治療 |
| ○ |
水口 雅 |
心身障害児総合医療療育センター
むらさき愛育園/小児科 |
薬物療法 |
| |
久保田雅也 |
社会福祉法人日本心身障害児協会
島田療育センター 神経内科/神経内科 |
薬物療法 |
| |
佐藤 敦志 |
東京大学医学部 小児科/小児科 |
薬物療法 |
| ○ |
坂本 博昭 |
大阪市立総合医療センター
小児脳神経外科/脳神経外科 |
放射線治療 |
| |
國廣 誉世 |
大阪市立総合医療センター
小児脳神経外科/脳神経外科 |
放射線治療 |
|

|
| 2. 作成経過
|

|
| |
2.1. 作成方針
|

|
| |
|
SEGAに対する治療選択肢が増えた中,エビデンスを整理し,病態分類に基づく診療アルゴリズムと診療ガイドラインを示すことによって,SEGAを合併する結節性硬化症患者の生命予後と機能予後の改善を目的とする。
|

|
| |
2.2. 使用上の注意
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.3. 利益相反
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.4. 作成資金
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.5. 組織編成
|

|
| |
|
ガイドライン統括委員会:ガイドライン作成を統括する脳腫瘍診療ガイドライン拡大委員会は,2009年11月に特定非営利活動法人 日本脳腫瘍学会の内部組織として設置され,当時の理事と協力委員3名で構成された。その後,特定非営利活動法人 日本脳腫瘍学会の新理事が委員として加わった。また,対象疾患ごとに関連学会から協力委員の参加を得ている。
ガイドライン作成グループ:脳腫瘍診療ガイドライン拡大委員会から選出された5名に加えて,新たに関連学会からの協力委員2名に参加いただいた。
システマティックレビューチーム:重要臨床課題ごとにSRチームを2~3名で編成した。対象とするSEGAが希少疾患であること,また,脳腫瘍診療ガイドライン拡大委員会として初めてのMindsに準拠するガイドライン作成であることをふまえて,各チームひとりずつガイドライン委員が兼任することとした。
|

|
| |
2.6. 作成過程
|

|
| |
|
準備:2014年11月30日の脳腫瘍診療ガイドライン拡大委員会で,SEGAのガイドライン作成グループが発足。上記のように7名の委員を決定した。
スコープ:ドラフトを作成し,メール回覧のうえ,メール討議を行い,改変を繰り返してver.1.5を完成させた。これを2015年10月20日に委員全体にメールで回覧し意見を募った。その後,アウトカムの設定など修正を加えたver.1.9.4をもって最終稿とした。
システマティックレビュー:2015年10月に開始。Minds 2014に準拠した方法に慣れていないため予想より時間を要した。さらに,SEGAという希少疾患の特殊性ゆえにエビデンスが少なく,Mindsに準拠した方法の適用が困難な場面に遭遇した。
推奨作成とその決定:重要臨床課題(CQ)ごとに担当委員が草案を作成し,メールで討議した。2016年10月16日にガイドライン作成グループによるミーティングを開催し,各CQに対する推奨の強さについて討議し,決定のための投票を行った。欠席者はメールで投票した。最終的に2016年12月4日の脳腫瘍診療ガイドライン拡大委員会にて参加委員全員の投票により決定した。
その他、小児脳腫瘍編 各ガイドライン共通項目参照も参照
最終化:小児脳腫瘍編 各ガイドライン共通項目参照
公開:2018年12月ホームページ上に公開した。
公開後の取り組み:小児脳腫瘍編 各ガイドライン共通項目参照
|

|
| |
2.7. 推奨の強さ・エビデンスレベル・その臨床的意義について
|

|
| |
|
共通目次と共通項目参照
|

|
| |
2.8. 外部評価を求めた団体・委員
|

|
| |
|
共通目次と共通項目参照
|

|
| 3.公開後の取り組み
|

|
| |
|
共通目次と共通項目参照
|

|
| 4.脳腫瘍診療ガイドライン拡大委員会(ガイドライン統括委員会)構成委員
|

|
| |
|
共通目次と共通項目参照
|

|
| 5.日本脳腫瘍学会 脳腫瘍診療ガイドライン作成事務局
|

|
| |
|
共通目次と共通項目参照
|

|
| 目次へ戻る!
|

|
| (Ⅴ)スコープ
|

|
| 1. 疾患トピックの基本的特徴
|

|
| |
1.1. 臨床的特徴
|

|
| |
|
上衣下巨細胞性星細胞腫(subependymal giant cell astrocytoma:SEGA)は,一部の特殊な症例(孤立性SEGA)を除き,結節性硬化症の患者に特異的に合併する中枢神経病変である。結節性硬化症は,SEGA,腎血管筋脂肪腫(angiomyolipoma:AML),肺リンパ脈管平滑筋腫症(lymphangioleiomyomatosis:LAM),顔面血管線維腫(facial angiofibroma)などの,TSC1遺伝子またはTSC2遺伝子の変異により発生する過誤腫や,てんかん,知的障害,自閉症などの行動異常をはじめとしたさまざまな症状を呈しうる全身性疾患である。結節性硬化症の診断は,臨床的診断基準に基づき,補助的診断として遺伝子診断が用いられる(表1)。臨床診断基準で結節性硬化症と診断できない不全型(モザイク等)の例が,数年を経過して診断されることがあるので注意を要する。
|

|
| |
表1 結節性硬化症の診断基準
(難病情報センターより引用 http://www.nanbyou.or.jp/entry/4385 )
1)遺伝学的診断基準
TSC1またはTSC2遺伝子の病因となる変異が正常組織からのDNAで同定されれば,結節性硬化症の確定診断(Definite)に十分である。病因となる変異は,TSC1またはTSC2タンパクの機能を不活化したり(例えばout-of-frame挿入・欠失変異やナンセンス変異),タンパク産生を妨げる(例えば大きなゲノム欠失)ことが明らかな変異,あるいはタンパク機能に及ぼす影響が機能解析により確立しているミスセンス変異と定義される。それ以外のTSC1またはTSC2遺伝子の変化で機能への影響がさほど確実でないものは,上記の基準を満たさず,結節性硬化症と確定診断するには不十分である。
結節性硬化症患者の10~25%では一般的な遺伝子検査で変異が同定されず,正常な検査結果が結節性硬化症を否定する訳ではなく,結節性硬化症の診断に臨床的診断基準を用いることに何ら影響を及ぼさない事に留意すべきである。
2)臨床的診断基準
a)大症状
①白斑(脱色素斑)(長径5mm以上の白斑3つ以上)註1
②顔面血管線維腫(3つ以上)または線維性頭部局面(前額線維性局面)
③爪(囲)線維腫(2つ以上)
④シャグリンパッチ(粒起革様皮)
⑤多発性網膜過誤腫
⑥皮質結節または大脳白質放射状神経細胞移動線(複数)註2
⑦上衣下結節(SEN)
⑧上衣下巨細胞性星細胞腫(SEGA)
⑨心横紋筋腫 註3
⑩肺リンパ脈管平滑筋腫症(LAM)註4,註5
⑪血管筋脂肪腫(AML)(2つ以上)註5,註6
b)小症状
①散在性小白斑(紙吹雪様皮膚病変,金平糖様白斑)
②歯エナメル小窩(3つ以上)
③口腔内線維腫(2つ以上)
④網膜無色素斑
⑤多発性腎嚢胞
⑥腎以外の過誤腫
c)注釈
註1:乳幼児期に生じたものに限る。
註2:皮質結節と大脳白質放射状神経細胞移動線がつながっている場合は1つと数える。
註3:胎児期,新生児期,乳児期に生じたものに限る。
註4:肺以外のリンパ脈管平滑筋腫症(LAM)を含めて良い。
註5:LAMとAMLは大症状であるが,この2つの組み合わせのみでは大症状1つと数えられ,他の症状がない場合は確定診断の
基準を満たさない。
註6:腎および腎以外のAMLを含む。
3)診断のカテゴリー
Definite(遺伝学的診断基準による確定診断):TSC1またはTSC2遺伝子の病因となる変異が正常組織からのDNAで同定される。
Definite(臨床的診断基準による確定診断):大症状2つ,または大症状1つと2つ以上の小症状のいずれかを満たす。
Probable(臨床的診断基準による疑い診断):大症状1つ,または小症状2つ以上のいずれかが認められる。
|
|

|
| |
|
SEGAは側脳室の上衣下層から発生するWHO grade 1の低悪性度の腫瘍である。ほとんどが側脳室のモンロー孔近傍に好発するが,側脳室壁や脳弓,内包,基底核など脳実質内の発生,多発性の報告がある。SEGAは出生時から発生していることがあるが,20~25歳以後に新たに発生することは稀である1)。SEGAは緩徐に増大するため,ある程度の大きさに達するまでは無症候であることが多いが,小児期から思春期にかけて発症することが多い。増大すると,神経脱落症状,視力障害,てんかんの悪化,認知障害の増強および行動変化などの臨床症状を引き起こす。いずれもモンロー孔の閉塞による水頭症が関与することが多く,さらに水頭症の悪化により,頭蓋内圧亢進症状をきたしたり,生命の危機に瀕する危険性がある。ただし,発達遅滞を伴っている患者も少なくなく,症状や体の不調を言葉で訴えられず,診断が遅れることが多いので注意を要する。また,急速な増大により腫瘍内出血をきたすことがある。
|

|
| 目次へ戻る!
|

|
| |
1.2. 疫学的特徴
|

|
| |
|
結節性硬化症患者の頻度は世界的に10,000人に1人と言われ,本邦でも同程度と考えられ2),全国でおよそ1万人の患者がいると推定されている。SEGAの結節性硬化症患者における発現率は5~20%といわれ1),結節性硬化症患者の死亡の原因の一つである3)。
|

|
| 目次へ戻る!
|

|
| |
1.3. 診療の全体的な流れ
|

|
| |
|
結節性硬化症に伴う神経病変としては,SEGAのほか,大脳皮質結節(cortical tuber),上衣下結節(subependymal nodule:SEN),放射状大脳白質神経細胞移動線が知られているが,臨床上SENとSEGAの鑑別が重要である(図1)。SEGAの画像診断基準(表2)は,「尾状核視床溝(caudothalamic groove)も含むモンロー孔近傍に位置する病変で,(1)最大径1cm以上,(2)経時的に増大する上衣下腫瘍(造影効果の有無を問わない)」となっている1)。通常SEGAでは著しい造影効果を示すが,増大傾向を示す上衣下病変では造影効果がなくともSEGAとみなすべき点に注意を要する。
|

|
| |
|
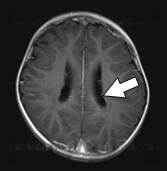
図1 結節性硬化症に伴う神経病変の画像所見 |
| |
| |
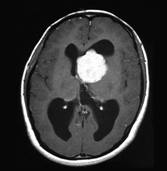
水頭症を伴うSEGA |
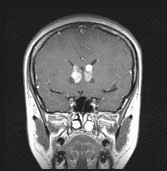
両側性SEGA |
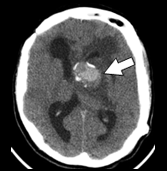
腫瘍内出血を起こしたSEGA |

|
上衣下結節(subependymal nodule:SEN) |
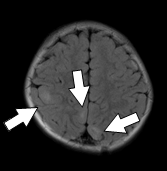
大脳皮質結節(cortical tuber) |
|
|

|
|
|
| |
| 表2 SEGAの画像診断基準(International Tuberous Sclerosis Complex Consensus Conference 2012)
|
尾状核視床溝(caudothalamic groove)も含むモンロー孔近傍に位置する病変で,以下の条件を満たすもの
(1)最大径1cm以上,
(2)経時的に増大する上衣下腫瘍(造影効果の有無を問わない)
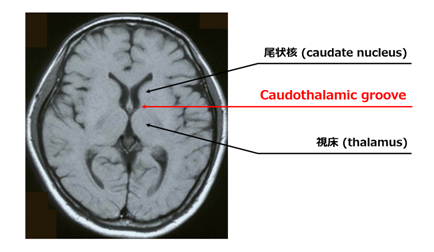
|
|

|
| |
|
なお,SENは5~10mm未満で通常造影されず増大しないが,SEGAに進展する可能性があるといわれている。したがって,結節性硬化症が疑われる患者では,まず診断のために神経学的評価と画像検査を行い,SEGAが発見された後も定期的な検査により経時的な観察を継続すれば,増大を早期に発見することができる。画像検査は,可能な限りMRI検査を行い必要に応じて造影も追加する。水頭症の有無もチェックする。ただし,知的障害・自閉症を伴う場合は鎮静下の検査となることもあるため,その適応と方法に特別な配慮が必要であり,場合によってはCT検査で代用される。
SEGAに対する治療は,腫瘍の制御と神経症状の予防ないし改善,水頭症のコントロールを目的とし,病態によって異なる。病態は,①急性症候性,②非急性症候性,③無症候性(増大あり),④無症候性(増大なし)の4段階に分類する(表3)1,4,)。
①急性症候性とは,急性閉塞性水頭症や腫瘍からの出血により症候性となり,ただちに治療を要する病態である。②非急性症候性とは,腫瘍に起因する非急性の神経症状や,説明のできない症状の悪化がみられる場合である。また,無症候性であっても,著しい脳室拡大や急速な拡大傾向,腫瘍周囲の著しい脳浮腫や脳圧排所見など,近い将来症候性になりうると考えられるsubclinicalの画像所見がみられるものを含む。③無症候性(増大あり)とは,腫瘍に起因する神経症状は認めないが,経時的な画像検査で腫瘍の増大傾向を認めているものである。④無症候性(増大なし)とは,腫瘍に起因する神経症状なく,経時的な画像所見でも腫瘍の増大傾向を認めないものである。
|

|
| |
表3 SEGAの病態分類
|
| |
| 病態分類 |
説明 |
| 急性症候性 |
急性閉塞性水頭症や腫瘍からの出血により症候性となり,ただちに治療を要するもの |
| 非急性症候性 |
腫瘍に起因する非急性の神経症状や,説明のできない症状の悪化がみられるもの
無症候性であっても,著しい脳室拡大や急速な拡大傾向,腫瘍周囲の著しい脳浮腫や脳圧排所見など,近い将来症候性になりうると考えられるsubclinicalの画像所見がみられるもの
|
| 無症候性(増大あり) |
腫瘍に起因する神経症状は認めないが,経時的な画像検査で腫瘍の増大傾向を認めているもの
|
| 無症候性(増大なし) |
腫瘍に起因する神経症状なく,経時的な画像検査でも腫瘍の増大傾向を認めないもの
|
|

|
| |
|
急性症候性の場合は外科的切除が第一選択であり,全摘出により治癒する可能性が高い。また,SEGAに伴う水頭症は,多くの場合は摘出により解消されるが,腫瘍摘出後にも脳室拡大・水頭症症状が改善しない場合には脳室-腹腔シャント術,あるいは脳室-脳槽間内シャント術の適応を検討する。なお,水頭症を伴うSEGAの外科的切除が速やかに行えない場合は,水頭症に対する外科的処置を行って一時的な症状の改善を行うことがあるが,外科的切除をいつどのようにして行うかなど,あらかじめSEGAに対する治療方法を十分に検討しておく必要がある。手術適応を検討するうえで,腎血管筋脂肪腫(AML)や肺リンパ脈管平滑筋腫症(LAM)などの合併症による全身状態を考慮する必要があるが,SEGAは,それらによる腎機能や肺機能の障害が出現する成人期よりも前に発症することが多いので,問題になることは少ない。非急性症候性,無症候性(増大あり)で,外科的切除が危険あるいは困難と判断される場合は薬物療法や放射線治療が行われることがある。また,外科的完全切除が困難な場合は手術前あるいは手術後に薬物療法や放射線治療が行われることがある。しかし,現状では非急性症候性や無症候性(増大あり)の状況での治療方針は明確ではないので,この点についてのクリニカルクエスチョンを主に作成した。
結節性硬化症の原因遺伝子であるTSC1とTSC2は,mTORシグナル伝達経路の負の調節因子であり,結節性硬化症に伴うSEGAの治療薬として,mTOR阻害薬が日本で2012年12月に承認された。mTOR阻害薬の有用性を示した臨床試験は,病状が安定しており手術を必要としないが,画像上増悪傾向のあるSEGAを対象としている5)。投与量は,血中薬物濃度を指標に調節する必要がある。腫瘍縮小効果が得られる率は高く,通常は3カ月以内の早い時期に効果が確認でき,投与継続により長期間にわたり腫瘍縮小効果が持続する。したがって,一般的な抗腫瘍薬に比べると,投与期間は長期になる。ただし,投与を中止すると,いったん縮小していた残存腫瘍が再増大することがある。また,間質性肺炎,感染症,口内炎などの副作用があり,安全性については,妊孕性などまだ明らかにされていない点もある。したがって,mTOR阻害薬は,外科的切除の対象とならない患者での有力な治療選択肢となりうるが,その適応は,現時点では明確な基準はなく,症例ごとに検討する必要がある。また,結節性硬化症に合併するてんかん,腎AML,皮膚病変に対して副次的効果が認められることもあるが,SEGA以外ではAMLに対してのみ承認されている。
いずれの治療を選択するかは,個々の症例ごとに,病状・病期,SEGAの治療歴,合併症の病状,手術の難易度,施設の経験値,患者・家族の希望,などを考慮して総合的に判断する。また,SEGAと診断され,画像検査によるフォローアップを行う場合は,腫瘍増大により起こりうる症状につき,患者ならびに家族が理解し対処できるよう,十分な説明を行う。
|

|
| |
【参考文献】
|
| |
| (1) |
Roth J, Roach ES, Bartels U, et al. Subependymal giant cell astrocytoma: diagnosis, screening, and treatment. Recommendations from the International Tuberous Sclerosis Complex Consensus Conference 2012. Pediatr Neurol. 2013; 49(6): 439-44.
[PMID: 24138953] |
| (2) |
Ohno K. Molecular epidemiology of tuberous sclerosis. In: Niimura M, Otsuka F, Hino O (eds.), Phacomatosis in Japan. Japan Scientific Press/Karger, Tokyo, 1999, pp53-71. |
| (3) |
Shepherd CW, Gomez MR, Lie JT, et al. Causes of death in patients with tuberous sclerosis. Mayo Clin Proc. 1991; 66(8): 792-6.
[PMID: 1861550] |
| (4) |
Krueger DA, Northrup H; International Tuberous Sclerosis Complex Consensus Group. Tuberous sclerosis complex surveillance and management: recommendations of the 2012 International Tuberous Sclerosis Complex Consensus Conference. Pediatr Neurol. 2013; 49(4): 255-65.
[PMID: 24053983] |
| (5) |
Franz DN, Belousova E, Sparagana S, et al. Efficacy and safety of everolimus for subependymal giant cell astrocytomas associated with tuberous sclerosis complex (EXIST-1): a multicentre, randomised, placebo-controlled phase 3 trial. Lancet. 2013; 381(9861): 125-32.
[PMID: 23158522] |
|

|
| 2. 診療ガイドラインがカバーする内容に関する事項
|
| |
| (1) |
タイトル:SEGAの診療ガイドライン。 |
| (2) |
目的:生命予後と機能予後の改善。 |
| (3) |
トピック:診断,生命予後と機能予後の改善。 |
| (4) |
想定される利用者,利用施設:小児および成人の脳腫瘍,結節性硬化症を診療する医療者,患者・家族。日本における一般的な医療が提供できる医療施設。 |
| (5) |
既存ガイドラインとの関係:海外では,2012年に結節性硬化症に関する国際コンセンサスカンファレンスが開催され,その討論の結果合意の得られた内容に関して,論文化されている。日本国内では,日本皮膚科学会から結節性硬化症の診断基準および治療ガイドラインが2008年に発表されており,その中にSEGAに関するガイドラインも含まれている。ただし本ガイドラインは,日本でmTOR阻害薬が結節性硬化症に合併するSEGAに対する治療として認可される前のガイドラインである。 |
| (6) |
重要臨床課題
課題1:診断
課題2:手術摘出
課題3:薬物療法
課題4:放射線治療
|
| (7) |
ガイドラインがカバーする範囲:結節性硬化症に合併するSEGAなお,結節性硬化症患者にみられるその他の神経系の異常や,他臓器の合併症は,本ガイドラインのカバーする範囲に含まれない。
|
|

|
| 3. システマティックレビューに関する事項
|
| |
| (1) |
実施スケジュール 文献検索:1カ月
文献の選出:1カ月
エビデンス総体の評価と統合:2カ月
|
| (2) |
エビデンスの検索
|
| |
① |
エビデンスタイプ
|
| |
|
・ |
既存のガイドライン:海外では,2012年に結節性硬化症に関する国際コンセンサスカンファレンスが開催され,その討論の結果合意の得られた内容に関して,SEGAについても論文化されている。日本国内では,日本皮膚科学会から結節性硬化症の診断基準および治療ガイドラインが2008年に発表されており,その中にSEGAに関するガイドラインも含まれている。
|
| |
|
・ |
個別研究論文:ランダム化比較試験(RCT)の報告は,海外から2報あるのみ。その他,非ランダム化比較試験,観察研究を検索対象にする。稀少疾患であるゆえに症例報告も重要であり検索対象にするが,選択する場合は理由を記載。
|
| |
② |
データベース
|
| |
|
・ |
個別研究論文: 主にPubMed
|
| |
|
・ |
systematic review/metaanalysis論文について: Cochraneになし
|
| |
|
・ |
既存のガイドラインの検索: 不要
|
| |
③ |
検索方法
|
| |
|
・ |
介入の検索に関してはPICOフォーマットを用いる。
|
| |
④ |
検索対象期間
|
| |
|
・ |
すべてのデータベースで2015年11月まで
|
| (3) |
文献の選択基準,除外項目
採択条件を満たす観察研究がない場合,システマティックレビューは実施しない。
|
| (4) |
エビデンスの評価と統合の方法
エビデンス総体の強さの評価は「Minds作成手引き2014」の方法に基づく。
エビデンス総体の統合は質的な統合を基本とし,適切な場合が量的統合を実施。
|
|

|
| 目次へ戻る!
|

|
| (Ⅵ)推奨
|

|
| 1. 画像診断:CQ1,CQ2
|

|
| |
1.1. サマリー
|

|
| |
| CQ1: |
結節性硬化症と診断された患者のフォローアップにおいて,頭部画像診断(MRIまたはCT)検査は無症候性SEGAの診断率を高めるために有用か?
|
| 推奨: |
結節性硬化症と診断された患者のフォローアップにおいて,無症候性SEGAの診断率を高めるために,頭部画像診断(MRIまたはCT)検査を行うことを提案する。(2C)
|
|
| |
| CQ2: |
非急性症候性または無症候性のSEGA患者に対して,定期的な頭部画像診断(MRIまたはCT)検査は有用か?
|
| 推奨: |
非急性症候性または無症候性のSEGA患者に対して,定期的な頭部画像診断(MRIまたはCT)検査を行うことを提案する。(2C)
|
|

|
| |
1.2 解説
|

|
| |
|
(1)CQの設定について
結節性硬化症に伴う神経病変としては,SEGAのほか,皮質結節,SEN,放射状大脳白質神経細胞移動線が知られているが,臨床上SENとSEGAの鑑別が重要である。SEGAは出生時から発生していることがあるが,20~25歳以後に新たに発生することは稀である。SEGAは緩徐に増大するため,ある程度の大きさに達するまでは無症候であることが多いが,小児期から思春期にかけてモンロー孔の閉塞による水頭症で発症することが多い。また,腫瘍内出血をきたすことがある。したがって,結節性硬化症が疑われる患者では,まず診断のために神経学的評価と画像検査を行い,その後も定期的な画像検査を継続して,SEGAの発生,増大を早期に発見する必要があると考えられている。
以上に基づき,CQに対する推奨を作成するためにアウトカムを以下のように設定した。
CQ1アウトカム:画像によりSEGAと診断した患者の割合
CQ2アウトカム:フォローアップ画像で増大を認めた患者の割合
|

|
| |
|
(2)推奨の解説
結節性硬化症にSEGAが合併することはよく知られているが,画像診断上のSEGAの定義については必ずしも統一された見解が存在しているわけでなく,文献ごとに異なるのが現状である。2012年に開催されたInternational Tuberous Sclerosis Complex Consensus Conference 2012では以下のように記載されている1)。
尾状核視床溝も含むモンロー孔近傍に位置する病変で以下のいずれかを示す。
1:最大径1cm以上
2:経時的に増大する上衣下腫瘍(造影効果の有無を問わない)
|

|
| |
|
CQ1
頭部画像検査,具体的にはMRI/CTが結節性硬化症と診断された患者において,無症候性SEGA診断率向上の有用性評価を直接の対象とした文献は認められなかった。一方で,限定された特定地域の結節性硬化症患者を対象とした画像診断における無症候性SEGAの診断について触れた文献が1編存在した2)。この文献では英国Wessexにおける結節性硬化症有病率は人口10万人あたり4.9名であり,無症候性結節性硬化症患者でMRI検査に同意した41名中7名17%でSEGAが診断されている。結節性硬化症治療センターにおける無症候性SEGAの診断に触れた文献も1編認められた3)。この文献の施設はオランダ全土における結節性硬化症患者の3次紹介医療センターであり,造影CTを施行した214名の患者中43名20%にSEGAを認めている。両側性SEGAは43名中9名21%,水頭症合併はSEGA患者中の6名14%であった。両文献のSEGA診断基準はMonro孔周辺に存在する最大径1cm以上あるいは造影効果を伴う病変であり,いずれもCTによる診断結果である。画像診断によるSEGA診断率には症候性および無症候性の症例も含まれる。そのため,症候性に対する手術施行例のみを対象とした従来のSEGA診断率より高い。これは,頭部画像診断が無症候性SEGAの診断率を高めるために有用であることを示唆する所見と考えられる。しかし,文献としてはいずれも症例集積であり,エビデンスレベルは低い。そのためエビデンス強度はC(弱い)とした。
SEGA自体は増大していく腫瘍である2,4-7,11)。SEGAの10%はSENから増大してくるとも言われ,SENの一部,とりわけモンロー孔周辺のSENでは経時的にSEGAに進展することがある1,7,11-13)。SEGAの増大は個人差もあり予測困難である。そのため,無症候性SENでも定期的画像経過観察が必要となる12)。経時的画像診断はSEGA前状態のSEN,あるいは発症初期のSEGAが明らかな腫瘍に増大していく過程を捉えることを可能とする1,7)。この点でも,頭部画像診断は無症候性SEGAの診断率を高めるために有用と考えられるが,文献のエビデンスレベルはいずれも低い。初回MRI/CTにてSEGAを認めなかった場合に経時的画像診断が必要か,もし必要とした場合に経過観察をどのくらいの間隔で行うか,について明確なエビデンスを示して記載した論文は認めなかった。International Tuberous Sclerosis Complex Consensus Conference 2012では,これまでにSEGAを発症していない無症状の結節性硬化症患者においても25歳までは1~3年毎のMRIを提言している14-16)。
注意すべきは石灰化のみのSEN病変はMRIでは診断困難であり4),ガドリニウム造影画像でも鑑別は困難な点にある5,17)。SEGAはほぼ全例石灰化を伴い,モンロー孔周辺から発生する。SENの石灰化はSEGAの石灰化より小さいが,SEGAに増大するSENはモンロー孔近傍に存在する。画像上はSENの所見のみであった5歳時より経過観察し,7歳時にSEN病変の腫瘍性増大を確認しSEGAと診断,その後12歳時に水頭症を生じた時点で手術を施行した長期経過観察例も報告されている 18)。無症候性結節性硬化症患者,とりわけ小児患児において,いずれかの時期にCT/MRIによるモンロー孔近傍部のSEN病変の存在確認は,その後のSEGAへの進展の可能性を予測する上で意義があると考えられる1,8,13)。
SEGAの診断について造影所見(+)を基にした場合と,結節の大きさ(>1cm)により診断している場合とがある。International Tuberous Sclerosis Complex Consensus Conference 2012では,増大しつつある腫瘍陰影を示せば大きさ・造影効果に関係なくSEGAと診断するとしている16)。また,診断法として古い論文ではCTを用い,1980年代後半以降ではMRIの占める割合が大きくなっている8,9,16)。厳密な意味で,各文献におけるSEGAの診断基準・診断法の非一貫性は明らかであるが,推奨作成にあたってはその点は考慮していないことに留意されたい。
推奨の決定は,委員全員の投票により行われたが,7割以上の賛成で原案の推奨文が可決された。
|

|
| |
|
CQ2
急性症候性SEGAでは外科治療の適応となる(CQ3参照)が,非急性症候性の一部または無症候性(腫瘍増大なし)の場合は経過観察となる。SEGAは経過観察中にも増大あるいは症状増悪する可能性があり,経過観察を行うにあたっては定期的画像検査が必要となる。非急性症候性または無症候性SEGA患者に対する定期的頭部画像診断検査の有用性を直接の検討対象とした文献は認められなかった。一方で,なんらかの治療対象となった患者における経時的SEGA増大が報告されている。Franz等はmTOR阻害薬のSEGAに対する有効性と安全性確立を目的にRCTを施行したが,その中のプラセボ群37名中6名16%に平均経過観察期間9.4カ月でSEGAの増大を認めている10)。他の文献も合わせるとSEGA増大は14~49%に認められている4,6)。Franz文献はRCTに基づくものであるが,プラセボ群におけるSEGA増大はあくまで副次的結果であり,論文の主眼とは異なる。そのため,この論文を持ってエビデンスレベルを上げることは問題があると考えられるので,エビデンス強度はC(弱い)とした。
SEGAの増大速度については個人差があるものの最大径で毎年1~10mm増大すると報告され,年平均の増大速度は4~5mmと推定されている4,6,11)。以上より,経時的に増大するSEGAに対して,非急性症候性または無症候性の時点であっても定期的に頭部画像診断検査を施行することは,急性症候性となる前段階での治療介入を可能とするので,臨床上有用と考えられる19)。
定期的頭部画像診断の頻度・期間に言及した文献は複数存在するが,RCTのような形で最適な画像診断頻度を検証した報告は認められない。SEGAの増大にはSEGA自体の大きさと,診断時の年齢が問題となる。SEGAの大きさとの関係では,Whelesらは5~10mm以上のSEGAでは3~6カ月毎,5mm以下では12カ月毎のMRI検査を勧めている20)。Jóźwiakらは1cm以上のSEGAに対しては半年毎のMRIを推奨している14)。年齢依存性に増大するSEGAでは,患者の年齢も重要である。Jóźwiakらは20歳までは2年毎のMRIが必要とし,それ以降は腫瘍の大きさが安定しているなら経過観察は不要と述べている14)。Jiangらは非手術例でSEGAが疑われたとき,あるいは手術例で全摘出できなかったときは3~6カ月毎のMRIを提言している6)。いずれの報告でも,SEGAが増大傾向にあるときは3~6カ月毎の検査を勧めている6,14,15)。CQ1の解説部分にも述べた通り,International Tuberous Sclerosis Complex Consensus Conference 2012では,これまでにSEGAを発症していない無症状の結節性硬化症患者において25歳までは1~3年毎のMRIを提言している14-16)。しかし,定期的画像診断の期間設定については,SEGAの増大速度以外の学術的根拠はなく,年齢・臨床経過(腫瘍増大経過)・非症候性水頭症(脳室拡大)の有無をもとに症例ごとに判断する必要があると考えられる。SEGA増大速度に関連する文献はいずれも症例集積の中での後方視的分析に基づくものであり,エビデンス強度を覆すだけの根拠はないと判断した。
推奨の決定は,委員全員の投票により行われたが,1回目の投票で原案に対する7割以上の賛成が得られなかったため,議論と投票を繰り返し,3回目の投票で決定した。議論のポイントとなったのは推奨の強さで,エビデンスの強さと実臨床に基づく確信の強さの間に乖離が生じたためであった。議論の末,現状としては,SEGAの自然歴に関しては,稀少疾患であるがゆえにまだまだ明らかでないことが多く,エビデンスも非常に少ないので,整合性に欠ける推奨をするほどでないという結論に至った。
最後に,CQ1,CQ2の画像診断に伴う患者・家族の負担について論じた論文は認めなかった。定期的画像診断検査に関しては,近年の報告はほとんどがMRIを用いて施行されている。しかし,小さな石灰化病変の検出はCTの方が優れている4)。また,発達障害を伴う小児の場合はMRI撮影時の鎮静麻酔施行が医療社会状況により本邦においては容易でないという特殊性を配慮すると,放射線曝露の問題は残るが,日常臨床においてはCTの有用性も考慮する必要がある[参照:MRI検査時の鎮静に関する共同提言 https://www.jpeds.or.jp/uploads/files/20150129.pdf (2015年1月29日に一部修正)日本小児科学会・日本小児麻酔学会・日本小児放射線学会]。どちらの検査手技を選択するかは施設毎・患者毎に個別に検討する必要があると考えられる。
なお,CQ1に関して推奨されている画像診断は1-3年毎,CQ2に関してSEGA診断後の画像診断はSEGAの大きさにより3-12カ月毎であり,早期診断・治療介入を可能とすることを考慮すると経済的に過度の負担になるとは考えにくく,医療経済的効果に見合った資源の利用になると考えられる。
|

|
| |
1.3 システマティックレビュー結果
|

|
| |
|
| # |
検索式 |
文献数 |
| #1 |
subependymal giant cell / radiology |
75 |
| #2 |
#1 AND diagnosis |
73 |
| #3 |
subependymal nodule / radiology |
17 |
| #4 |
#1 AND #3 |
5 |
| #5 |
#1 OR #3 |
87 |
| #6 |
#1 OR #3 Filters: Abstract; Humans; English |
60 |
|

|
| |
|
検索wordはsubependymal giant cell astrocytoma, radiology,diagnosis,seubependymal noduleを用い,PubMed上でANDあるいはORで組み合わせた上で,abstract,human,englishでフィルターをかけた。その結果,60件の文献を検討対象候補とした。さらに関連文献などを通し3文献を追加した63文献を選出した。
これらの抄録を第1回スクリーニング対象とし,CQと関連性が高いと考えられた30文献を選出した。SEGAそのものが稀少疾患であることを反映し,画像診断そのものを対象とした前方視的研究はなく,多くが症例集積・報告に準じる論文であった。
ガイドライン作成にあたっては,この中より各CQに対応している情報を含んだ10文献を選択し,システマティックレビューを行った。
CQ1に関しては,結節性硬化症と診断された患者において,無症候性SEGA診断率向上の有用性評価を直接の対象とした文献は認めなかった。特定地域の結節性硬化症患者を対象とした画像診断における無症候性SEGAの診断について触れた文献では無症候性結節性硬化症患者でMRI検査に同意した41名中7名17%でSEGAが診断されている。結節性硬化症治療センターにおける無症候性SEGAの診断に触れた文献では造影CTを施行した214名の患者中43名20%にSEGAを認めている。
CQ2に関しては,定期的頭部画像診断検査の有用性を直接の検討対象とした文献は認めなかった。一方で,mTOR阻害薬のSEGAに対する有効性と安全性確立を目的にランダム化比較試験(RCT)を施行した文献において論文の主眼と異なる副次的前方視的結果ではあるが,プラセボ群37名中6名16%に平均経過観察期間9.4カ月でSEGAの増大を認めたと報告されている。他の文献も合わせるとSEGA増大は14~49%に認められている。
なお,稀少疾患であるSEGAにおいては,症例集積・症例報告も重要となるため,内容に応じて推奨および解説作成に採用した。しかし,ここで採用した症例集積文献の中で,50例以上の母集団を持つ論文は1編のみであった。
|

|
| 目次へ戻る!
|

|
| |
1.4 引用文献
|

|
| |
| |
【システマティックレビュー採用論文】
|
| |
| 1) |
Nabbout R, Santos M, Rolland Y, et al. Early diagnosis of subependymal giant cell astrocytoma in children with tuberous sclerosis. J Neurol Neurosurg Psychiatry. 1999; 66(3): 370-5.
[PMID: 10084537] |
| 2) |
O'Callaghan FJ, Martyn CN, Renowden S, et al. Subependymal nodules, giant cell astrocytomas and the tuberous sclerosis complex: a population-based study. Arch Dis Child. 2008; 93(9): 751-4.
[PMID: 18456692] |
| 3) |
Adriaensen ME, Schaefer-Prokop CM, Stijnen T, et al. Prevalence of subependymal giant cell tumors in patients with tuberous sclerosis and a review of the literature. Eur J Neurol. 2009; 16(6): 691-6.
[PMID: 19236458] |
| 4) |
Cuccia V, Zuccaro G, Sosa F, et al. Subependymal giant cell astrocytoma in children with tuberous sclerosis. Childs Nerv Syst. 2003; 19(4): 232-43.
[PMID: 12715190] |
| 5) |
Harter DH, Bassani L, Rodgers SD, et al. A management strategy for intraventricular subependymal giant cell astrocytomas in tuberous sclerosis complex. J Neurosurg Pediatr. 2014; 13(1): 21-8.
[PMID: 24180681] |
| 6) |
Jiang T, Jia G, Ma Z,et al. The diagnosis and treatment of subependymal giant cell astrocytoma combined with tuberous sclerosis. Childs Nerv Syst. 2011; 27(1): 55-62.
[PMID: 20422196] |
| 7) |
Torres OA, Roach ES, Delgado MR, et al. Early diagnosis of subependymal giant cell astrocytoma in patients with tuberous sclerosis. J Child Neurol. 1998; 13(4): 173-7.
[PMID: 9568761] |
| 8) |
Altman NR, Purser RK, Post MJ. Tuberous sclerosis: characteristics at CT and MR imaging. Radiology. 1988; 167(2): 527-32.
[PMID: 3357966] |
| 9) |
McMurdo SK Jr, Moore SG, Brant-Zawadzki M, et al. MR imaging of intracranial tuberous sclerosis. AJR Am J Roentgenol. 1987; 148(4): 791-6.
[PMID: 3493666] |
| 10) |
Franz DN, Belousova E, Sparagana S, et al. Efficacy and safety of everolimus for subependymal giant cell astrocytomas associated with tuberous sclerosis complex (EXIST-1): a multicentre, randomised, placebo-controlled phase 3 trial. Lancet. 2013; 381(9861): 125-32.
[PMID: 23158522] |
|
|

|
| |
| |
【その他の参考論文】
|
| |
| 11) |
Ouyang T, Zhang N, Benjamin T, et al. Subependymal giant cell astrocytoma: current concepts, management, and future directions. Childs Nerv Syst. 2014; 30(4): 561-70.
[PMID: 24549759] |
| 12) |
Nishio S, Morioka T, Suzuki S, et al. Subependymal giant cell astrocytoma: clinical and neuroimaging features of four cases. J Clin Neurosci. 2001; 8(1): 31-4.
[PMID: 11322123] |
| 13) |
Northrup H, Krueger DA; International Tuberous Sclerosis Complex Consensus Group. Tuberous sclerosis complex diagnostic criteria update: recommendations of the 2012 Iinternational Tuberous Sclerosis Complex Consensus Conference. Pediatr Neurol. 2013; 49(4): 243-54.
[PMID: 24053982] |
| 14) |
Jóźwiak S, Nabbout R, Curatolo P; participants of the TSC Consensus Meeting for SEGA and Epilepsy Management. Management of subependymal giant cell astrocytoma (SEGA) associated with tuberous sclerosis complex (TSC): Clinical recommendations. Eur J Paediatr Neurol. 2013; 17(4): 348-52.
[PMID: 23391693] |
| 15) |
Krueger DA, Northrup H; International Tuberous Sclerosis Complex Consensus Group. Tuberous sclerosis complex surveillance and management: recommendations of the 2012 International Tuberous Sclerosis Complex Consensus Conference. Pediatr Neurol. 2013; 49(4): 255-65.
[PMID: 24053983] |
| 16) |
Roth J, Roach ES, Bartels U, et al. Subependymal giant cell astrocytoma: diagnosis, screening, and treatment. Recommendations from the International Tuberous Sclerosis Complex Consensus Conference 2012. Pediatr Neurol. 2013; 49(6): 439-44.
[PMID: 24138953] |
| 17) |
Pinto Gama HP, da Rocha AJ, Braga FT, et al. Comparative analysis of MR sequences to detect structural brain lesions in tuberous sclerosis. Pediatr Radiol. 2006; 36(2): 119-25.
[PMID: 16283285] |
| 18) |
Morimoto K, Mogami H. Sequential CT study of subependymal giant-cell astrocytoma associated with tuberous sclerosis. Case report. J Neurosurg. 1986; 65(6): 874-7.
[PMID: 3772487] |
| 19) |
de Ribaupierre S, Dorfmüller G, Bulteau C, et al. Subependymal giant-cell astrocytomas in pediatric tuberous sclerosis disease: when should we operate? Neurosurgery. 2007; 60(1): 83-89; discussion 89-90.
[PMID: 17228255] |
| 20) |
Wheless JW, Klimo P Jr. Subependymal giant cell astrocytomas in patients with tuberous sclerosis complex: considerations for surgical or pharmacotherapeutic intervention. J Child Neurol. 2014; 29(11): 1562-71.
[PMID: 24105488] |
|
|

|
| 目次へ戻る!
|

|
| 2. 手術:CQ3
|

|
| |
2.1 サマリー
|

|
| |
| CQ3: |
非急性症候性または無症候性(増大あり)のSEGAに対する外科的摘出は,急性症候性となってから行われる場合と比較して有用か?
|
|

|
| |
2.2 解説
|

|
| |
(1)CQの設定
International Tuberous Sclerosis Complex Consensus 2012には,SEGAに対する唯一の治療法は外科的切除であると記載されている。SEGAは急性症候性・非急性症候性・無症候性(腫瘍増大あり)・無症候性(腫瘍増大なし)の4つの病態に分類可能であるが,手術療法を適応する上で一番問題となるのは,非急性症候性または無症候性(増大あり)の場合であり,下記のようなクリニカルクエスチョンとアウトカムを作成した。
CQ:非急性症候性または無症候性(増大あり)のSEGAに対する外科的摘出は,急性症候性となってから行われる場合と比較して有用か? |
|
| |
|
アウトカム: |
1)有害事象・QOL低下
2)全摘出率
3)再発率・再摘出率
|
|
| |
(2)推奨の解説
SEGAは全摘出することにより完治せしめることが可能である4)。急性症候性では生命の危機から脱却するために手術摘出が最優先される5)。また無症候性(腫瘍増大なし)の場合は経過観察で構わない。これらに関しては同意が得られている。
非急性症候性または無症候性(増大あり)のSEGAに対しての最良の治療選択肢を決めるには,意志決定過程において,①予想される腫瘍拡大速度,②mTOR 阻害薬使用時の期待される腫瘍抑制効果と長期使用による合併症,③手術合併症リスク・有害事象,④費用,⑤治療期間,⑥結節性硬化症関連併存疾患への影響度,について考慮する必要がある4,5)。①については腫瘍増大速度は個人差が大きく予測困難,②は現時点で不明である。③と⑤に関しては,後述のように多分に術者の技量に依存し施設間較差が大きいために一般化することができない。④に関しては,結節性硬化症は,2015年7月に難病指定を受けており,成人も含め医療経済的には負担が軽減されているが,検査,治療,入院に伴う負担は小さくない。手術効果による医療費減免効果は不明である。⑥は個別に検討せざるを得ない。以上のような理由に加えて,それぞれの治療方法に対する患者(家族)の理解度の違いと治療に対する好みが加わるため,この治療に対する患者(家族)の意向は,大きくばらつくと考えられる。
残念ながら,過去の報告からSEGAに対する手術による有害事象発生率・全摘出率・再発率・再摘出率といった確率に対しては全く返答不能であり,QOL低下・水頭症の改善・予防といった内容に関しては定性的返答さえも不可能であった。
合併症発生に関して,わずかながらKotulska(Poland)1),2014とHarter(USA),20142)の論文が論じている。Kotulskaらの論文1)では,Polandの多施設において2000~2012年に治療した57例(64腫瘍)中4例(6.2%)が術後に死亡している。死亡4例のうち,3例が術後7日以内の死亡であり,1例は痙攣重積,1例は後出血,1例は心停止であった。残る1例は残存腫瘍の急な増大に伴う急性水頭症で3カ月後に死亡していた。手術合併症は,片麻痺,水頭症,出血,認知機能低下が主なものであった。手術合併症発生率は腫瘍径<2cm,2~3cm,3~4cm,>4cm,両側性腫瘍でそれぞれ0%,30.8%,66.7 %,73%, 67%であった。また,3歳以下の小児や症候性の症例に頻度が高い傾向を認めた。以上より,予後不良因子としては,3歳未満,両側性腫瘍,腫瘍径2cm以上,症候性,部分切除,を指摘している。一方Harterらの論文2)では, New York University Langone Medical Center単施設において1997~2011年に治療した18例(22腫瘍)を検討し,手術死亡はなく,急性合併症発生頻度は例中2例で,いずれも回復したと報告している。彼らは90.9%に全摘出もしくはほぼ全摘出に近い亜全摘出を達成し,これらの再発はなかったものの,全体の半数に脳室腹腔短絡術が必要であったことを注意している。ちなみに過去の報告では,脳室腹腔短絡術は6~27%で行われていた。
手術時期を考える上で,合併症発生率は腫瘍径が2~3cm以下での治療成績が良好であるという報告が多く1,4,6,7),手術決断の一つの目安にはなるかもしれない。しかし,ゆっくりと進行し,しかもある年齢(20歳代半ば)に達すると腫瘍拡大が停止する5)腫瘍に対して,必ず合併症発生のリスクを伴う手術介入時期の決定はやはり難しい。その理由は,前述のように,①腫瘍増大速度は個人差が大きく拡大速度を予想する方法がないために,「急性症候性になる前」を正確に判断することができないこと,②mTOR阻害薬2,4,5,8)が使用可能となっているものの,非急性症候性または無症候性(増大あり)の段階で,この薬剤を使用した後の反応性と長期投与による合併症発生が予想できないこと,が主な理由となる。今後この2点を解明しない限り,手術時期の推奨は明らかにはできないと考えられる。
特殊な事例としてcongenital(neonatal)SEGA3,9)・両側性病変があげられるが,前者に対しては,生後待機的に手術を行うことで良好な予後が得られる可能性が示唆されているため,できれば新生児期を過ぎるまで水頭症を管理して経過を見た上での摘出3)を,後者に対しては二期的手術も考慮すべきであると報告2)されている。
|
|

|
| |
2.3 システマティックレビュー結果
|

|
| |
このクリニカルクエスチョンに答えるために,下記検索式にて2015年11月に文献検索を行った。
|

|
| |
|
| # |
検索式 |
文献数 |
| #1 |
"subependymal giant cell"[All Fields] |
390 |
| #2 |
(Astrocytoma/surgery[mesh] OR Brain Neoplasms/surgery[mesh] OR Brain/surgery[mesh] OR Neurosurgical Procedures[mesh] OR Microsurgery[mesh]) |
|
| #3 |
#1 AND #2 |
79 |
|

|
| |
|
この79論文すべてに対してシステマティックレビューを行い,まず構造化抄録を作成した。
この結果,エビデンスとしては前向き比較試験は存在せず,サンプルサイズとしても最大で57例(Kotulska,2014)の後方視的検討であった。したがって手術療法に関して学術的検討を行うデータはほとんどcase report,case seriesに頼るしかなかった。
アウトカムとして設定した3項目に,バイアスリスクなくアウトカムに答えることのできる論文は基本的に存在していなかった。この中である程度参考になる論文として,Kotulska,20141)とHarter,20142)の論文が挙げられるが,有害事象発生率・全摘出率・再発率・再摘出率といった確率に対しては全く返答不能であり,QOL低下・水頭症の改善・予防といった内容に関しては定性的返答も不能であった。
したがって,手術療法で設定した今回のクリニカルクエスチョンに対しての推奨文は, case report,case seriesと3つのInternational Tuberous Sclerosis Complex Consensus Conference 2012の報告4,5,9)を定性的にまとめたものとなった。
非急性症候性または無症候性(増大あり)のSEGAに対する手術療法を選択する上で,一番問題となるのは,そのタイミングであるが,自然経過の中での腫瘍増大の予測と,mTOR阻害薬使用後の腫瘍抑制効果の2点がポイントとなると思われる。前者に関しては画像followと腫瘍拡大に関する論文から4~5mm/年というデータが存在するが確証されておらず,後者に関してはmTOR阻害薬使用後の超長期成績が存在しないために,現時点ではやはり明らかなデータが存在しないと言わざるを得ない。
推奨の決定は,委員全員の投票により行われたが,7割以上の賛成で原案の推奨文が可決された。
|

|
| 目次へ戻る!
|

|
| |
2.4 引用文献
|

|
| |
| |
【システマティックレビュー採用論文】
|
| |
| 1) |
Kotulska K, Borkowska J, Roszkowski M, et al. Surgical treatment of subependymal giant cell astrocytoma in tuberous sclerosis complex patients. Pediatr Neurol. 2014; 50(4): 307-12.
[PMID: 24507694] |
| 2) |
Harter DH, Bassani L, Rodgers SD, et al. A management strategy for intraventricular subependymal giant cell astrocytomas in tuberous sclerosis complex. J Neurosurg Pediatr. 2014; 13(1): 21-8.
[PMID: 24180681] |
| 3) |
otulska K, Borkowska J, Mandera M, et al. Congenital subependymal giant cell astrocytomas in patients with tuberous sclerosis complex. Childs Nerv Syst. 2014; 30(12):2037-42.
[PMID: 25227171] |
|
|

|
| |
| |
【その他の参考論文】
|
| |
| 4) |
Roth J, Roach ES, Bartels U, et al. Subependymal giant cell astrocytoma: diagnosis, screening, and treatment. Recommendations from the International Tuberous Sclerosis Complex Consensus Conference 2012. Pediatr Neurol. 2013; 49(6): 439-44.
[PMID: 24138953] |
| 5) |
Krueger DA, Northrup H; International Tuberous Sclerosis Complex Consensus Group. Tuberous sclerosis complex surveillance and management: recommendations of the 2012 International Tuberous Sclerosis Complex Consensus Conference. Pediatr Neurol. 2013; 49(4): 255-65.
[PMID: 24053983] |
| 6) |
Berhouma M. Management of subependymal giant cell tumors in tuberous sclerosis complex: the neurosurgeon's perspective. World J Pediatr. 2010; 6(2): 103-10.
[PMID: 20490765] |
| 7) |
Moavero R, Pinci M, Bombardieri R, et al. The management of subependymal giant cell tumors in tuberous sclerosis: a clinician's perspective. Childs Nerv Syst. 2011; 27(8): 1203-10.
[PMID: 21305305] |
| 8) |
Wheless JW, Klimo P Jr. Subependymal giant cell astrocytomas in patients with tuberous sclerosis complex: considerations for surgical or pharmacotherapeutic intervention. J Child Neurol. 2014; 29(11): 1562-71.
[PMID: 24105488] |
| 9) |
Northrup H, Krueger DA; International Tuberous Sclerosis Complex Consensus Group. Tuberous sclerosis complex diagnostic criteria update: recommendations of the 2012 Iinternational Tuberous Sclerosis Complex Consensus Conference. Pediatr Neurol. 2013; 49(4): 243-54.
[PMID: 24053982] |
|
|

|
| 目次へ戻る!
|

|
| 3. 薬物療法:CQ4
|

|
| |
3.1 サマリー
|

|
| |
| CQ4: |
非急性症候性または無症候性(増大あり)のSEGAに対して,外科的切除の対象とならない場合に mTOR阻害薬投与は有用か?
|
| 推奨: |
非急性症候性または無症候性(増大あり)のSEGAに対して,外科的切除の対象とならない場合に mTOR阻害薬の投与を提案する。(2C)
|
|

|
| |
3.2 解説
|

|
| |
(1)CQの設定
SEGAを治療するためのmTOR阻害薬による薬物療法については近年,多くの論文が刊行されてきた。非急性症候性または無症候性(増大あり)のSEGAは,全摘出できれば治癒が期待できる。そこで,薬物療法の適応となるのは外科的切除の対象とならない場合(多発性あるいは浸潤性の腫瘍,腫瘍が摘出不能部位にある,全身合併症により心・肺・腎機能に重度の障害がある,術後の残存腫瘍あるいは再発で複雑化した病態にある,患者が手術を拒否した場合など)である。下記のようなクリニカルクエスチョンとアウトカムを作成した。
CQ:非急性症候性または無症候性(増大あり)のSEGAに対して,外科的切除の対象とならない場合に mTOR阻害薬投与は有用か?
|
|
| |
|
アウトカム: |
1)腫瘍体積の縮小(50%以上)
2)副作用(全てのグレード,グレード3~4)
|
|
| |
(2)推奨の解説
結節性硬化症の原因遺伝子としてTSC2(1993年),TSC1(1997年)が同定されたことを契機として結節性硬化症の病態解明が急速に進んだ。両遺伝子のタンパク産物は複合体を形成し,mammalian(またはmechanistic)target of rapamycin(mTOR)信号伝達系の中流に位置し,この系を抑制的に制御する。結節性硬化症の主たる病態はmTOR系下流の異常な活性亢進であること,また結節性硬化症に伴うSEGAや腎血管筋脂肪腫(AML)では体細胞変異などの機序によりmTOR活性がさらに高まっていることが解明された。これらの知見にもとづき,結節性硬化症に伴う腫瘍の治療としてmTOR阻害薬による化学療法が始められた。mTOR阻害薬にはラパマイシン(シロリムス)とその誘導体であるエベロリムス,テムシロリムスなど(ラパログと総称される)がある。これらの薬物は,薬物代謝上の若干の違いはあるものの,薬効や副作用はほとんど変わらない。はじめ臓器移植後の免疫抑制薬として開発されたが,のちに悪性・良性腫瘍に対する抗腫瘍薬,ステント血栓症予防薬として応用が広がった。
結節性硬化症に伴うSEGAを治療するためのmTOR阻害薬としては,シロリムスが2006年から,エベロリムスが2010年から報告され始めた。関連する論文は数十に及ぶものの,その中で多数の症例を集積しエビデンスの基盤となりうる研究は5論文(うちRCT 1論文1),症例集積4論文2-5))と僅少であった。
mTOR阻害薬の益(効果)に関わるアウトカムとして,無イベント生存率(EFS)延長や生活の質(QOL)向上に関する有用な情報はこれらの研究には乏しく,腫瘍サイズ減少が事実上唯一の指標であった。mTOR阻害薬の投与を6カ月~3年にわたって続けた後に32~56%の患者で50%以上の腫瘍体積縮小が観察されたことから1-5),エビデンスとしてはまだ弱いながらも,mTOR阻害薬の腫瘍縮小効果は確実と考えられた。ただし,本研究における薬物用量は,本邦における用量と異なる点がシステマティックレビューにおいて非直接性のバイアスとして指摘されている。大多数の患者の臨床経過として,投与開始後3カ月後には腫瘍が縮小し,投与を続ける限り3年程度はその効果が持続する。しかし腫瘍が消失することはない。また投薬を中止するとその後に腫瘍が再び増大することが報告されていた。なお,3年を超える長期間にわたって薬物療法を継続する必要があるのか,継続した際に効果は持続するのかについては,いまだ知見がなかった。また治療開始の基準,手術療法との優劣,術前化学療法(ネオアジュバント化学療法)に関する研究もなかった。mTOR阻害薬内服は全身療法であるため,SEGA以外の結節性硬化症症状(顔面血管線維腫,腎血管筋脂肪腫,てんかん,自閉症ほか)に対する副次的効果も期待されるが,これについての記載もきわめて乏しかった。
mTOR阻害薬の害(有害事象)に関しては口内炎,感染症など多彩な副作用が記載されていたが,グレード3~4の重大な副作用の頻度は高くなく,概ね忍容可能と判断されていた。口内炎ないし口腔内潰瘍は大多数の患者(およそ80%)に見られる副作用である。投与開始直後の数カ月に多く,それを過ぎると減る傾向があるとされる。感染症も高頻度に見られ,胃腸炎,肺炎,上気道炎,中耳炎,結膜炎などが記載されていた2-5)。その多くは軽症で,mTOR阻害薬との因果関係も明瞭でない。しかし少数ながら重篤な肺炎,敗血症や肝炎の報告も散見される。月経異常(無月経など),皮疹(痤瘡ないし痤瘡様発疹),血液検査異常(コレステロール,トリグリセリドの高値)はそれぞれ10%以上に見られた2-5)。またmTOR阻害薬投与に際しては,低頻度だが重篤となりやすい間質性肺疾患への注意が求められる。なお,小児の成長発達,将来の生殖能力などを含めた長期的な問題については,いまだ知見がきわめて乏しい。
以上より,現段階でmTOR阻害薬による薬物療法については,益が害を上回り,推奨に値する治療オプションの一つである。しかし長期的な益と害に関する知見が不足しており,今後さらなる研究が必要と考えられた。
推奨の決定は,委員全員の投票により行われたが,7割以上の賛成で原案の推奨文が可決された。
|
|

|
| |
3.3 システマティックレビュー結果
|

|
| |
このクリニカルクエスチョンに答えるために,下記検索式にて2015年11月に文献検索を行った。
|

|
| |
|
| # |
検索式 |
文献数 |
| #1 |
"subependymal giant cell"[All Fields] |
402 |
| #2 |
astrocytoma/drug therapy[mesh] |
7,754 |
| #3 |
Tuberous sclerosis/drug therapy[mesh] |
566 |
| #4 |
#2 or #3 |
82,865 |
| #5 |
#1 AND #4 |
58 |
|

|
| |
|
この58論文から一次スクリーニングで32論文を選んで集め,システマティックレビューを行い,まず構造化抄録を作成した。
これらの論文中,多数の症例を集積しエビデンスの基盤となりうる研究は僅少であり,二次スクリーニング後には5論文(RCT 11),症例集積 42-5))しか残らなかった。
これらの論文ではmTOR阻害薬投与を6月~3年続けた後に32~56%の症例で50%以上の腫瘍体積縮小が観察されたことから,エビデンスとしては弱いながらも,mTOR阻害薬の益(腫瘍縮小効果)は確実と考えられた。ただし3年を超える長期間,薬物療法を継続する必要があるのか,継続した際に効果は持続するのかについては,いまだ知見がない現状である。
mTOR阻害薬の害(有害事象)に関しては口腔内潰瘍,感染症など多彩な副作用が記載されているが,グレード3〜4の重大な副作用の頻度は高くなく,概ね忍容可能と判断された。ただし小児の成長発達,将来の生殖能力などを含めた長期的な問題については十分な知見が得られていない。
また薬価が非常に高価であり,治療期間が長い年月にわたるため,患者または行政にかかる費用負担が大きいことも問題となりうる。
以上より,現段階でmTOR阻害薬による薬物療法については,益が害を上回り,推奨に値する治療オプションの一つと考えられるが,長期的な益と害に関する知見が不足しており,今後さらなる研究が必要と考えられた。
|

|
| 目次へ戻る!
|

|
| |
3.4 引用文献
|

|
| |
| 1) |
Franz DN, Belousova E, Sparagana S, et al. Efficacy and safety of everolimus for subependymal giant cell astrocytomas associated with tuberous sclerosis complex (EXIST-1): a multicentre, randomised, placebo-controlled phase 3 trial. Lancet. 2013; 381(9861): 125-32.
[PMID: 23158522] |
| 2) |
Franz DN, Leonard J, Tudor C, et al. Rapamycin causes regression of astrocytomas in tuberous sclerosis complex. Ann Neurol. 2006; 59(3): 490-8.
[PMID: 16453317] |
| 3) |
Krueger DA, Care MM, Holland K, et al. Everolimus for subependymal giant-cell astrocytomas in tuberous sclerosis. N Engl J Med. 2010; 363(19): 1801-11.
[PMID: 21047224] |
| 4) |
Krueger DA, Care MM, Agricola K, et al. Everolimus long-term safety and efficacy in subependymal giant cell astrocytoma. Neurology. 2013; 80(6): 574-80.
[PMID: 23325902] |
| 5) |
Franz DN, Belousova E, Sparagana S, et al. Everolimus for subependymal giant cell astrocytoma in patients with tuberous sclerosis complex: 2-year open-label extension of the randomised EXIST-1 study. Lancet Oncol. 2014; 15(13): 1513-20.
[PMID: 25456370] |
|

